بِسْمِ اللّٰهِ الرَّحْمٰنِ الرَّحِيْمِ
A. Definisi
Hidrokarbon
Hidrokarbon adalah
sebuah senyawa yang terdiri dari unsur karbon (C) dan hidrogen (H). (model
atom karbon dan hidrogen ditampilkan)
Salah satu contoh
senyawa hidrokarbon yang sederhana adalah metana, dengan rumus struktur CH4.
(model struktur senyawa metana)
Dalam kimia karbon
adalah penting bagi kita untuk dapat menuliskan rumus molekul dan rumus
struktur. Rumus molekul menyatakan jumlah atom setiap unsur yang ada dalam
suatu molekul. Sedangkan rumus struktur menggambarkan bagaimana atom-atom itu
terikat satu sama lain. (tampilkan sebagai contoh rumus molekul CH4 dan
rumus struktur CH4).
B. Kekhasan
Atom Karbon
Atom karbon mempunyai
nomor atom 6
Konfigurasi 6C -12 : 1s2 2s2 2p2 , maka
electron valensinya adalah 4
Gambar ikatan pada
atom karbon
I
- C
-
I
Jadi cirikhas atom karbon
selalu mempunyai 4 ikatan kovalen dan dapat membentuk rantai karbon yang sangat
panjang.
C.
Jenis-Jenis
ikatan pada atom karbon(C)
1. Atom C primer ; yaitu atom C yang mengikat
satu atom C yang lain
2. Atom C sekunder; yaitu atom C yang mengikat
dua atom C yang lain
3. Atom C tersier ; yaitu atom C yang mengikat
tiga atom C yang lai
4. Atom C Kuartener; yaitu atom C yang mengikat
empat atom C yang lain
Alkana merupakan senyawa hidrokarbon alifatik jenuh, yaitu
hidrokarbon dengan rantai terbuka dan semua ikatan karbonnya merupakan ikatan
tunggal. Senyawa alkana merupakan rantai karbon yang paling sederhana.. Senyawa
paling sederhana dari alkana yaitu metana. Metana hanya memiliki satu atom
karbon yang mengikat empat atom H. Senyawa alkana mempunyai rumus :
Rumus Umum Alkana :CnH2n + 2
Tabel 1. Deret homogon dari rumus struktur, rumus molekul, dan
tata nama senyawa alkana [1]
Jumlah Karbon
|
Rumus Molekul
|
Struktur
|
Nama
|
1
|
CH4
|
CH4
|
Metana
|
2
|
C2H6
|
CH3 – CH3
|
Etana
|
3
|
C3H8
|
CH3 – CH2 –
CH3
|
Propana
|
4
|
C4H10
|
CH3 – (CH2)2 –
CH3
|
Butana
|
5
|
C5H12
|
CH3 – (CH2)3 –
CH3
|
Pentana
|
6
|
C6H14
|
CH3 – (CH2)4 –
CH3
|
Heksana
|
7
|
C7H16
|
CH3 – (CH2)5 –
CH3
|
Heptana
|
8
|
C8H18
|
CH3 – (CH2)6 –
CH3
|
Oktana
|
9
|
C9H20
|
CH3 – (CH2)7 –
CH3
|
Nonana
|
10
|
C10H22
|
CH3 – (CH2)8 –
CH3
|
Dekana
|
Berdasarkan tabel di atas dapat dilihat bahwa perbedaan
kesepuluh senyawa di atas terletak pada jumlah (–CH2–).
Senyawa dengan kondisi demikian disebut homolog. Susunan senyawa yang dibuat
sedemikian rupa sehingga perbedaan dengan tetangga dekatnya hanya pada jumlah
metilena disebut deret homolog.
E. Gugus
Alkil
Gugus
alkil adalah alkana yang telah kehilangan satu atom H. Gugus alkil ini
dapat dituliskan dengan menggunakan rumus:
CnH2n +
1
Dengan
menggantikan satu atom H, maka namanya juga akan berubah dari metana menjadi
metil. Berikut ini beberapa gugus alkil yang biasa digunakan.
Rumus
|
Nama
Alkil
|
CH3
–
|
Metil
|
C2H5
–
|
Etil
|
C3H7
–
|
Propil
|
C4H9
–
|
Butil
|
Gugus metil
dan gugus etil masing-masing hanya sejenis, yait
Aturan tata nama alkana
Berdasarkan aturan IUPAC (Internasional Union of Pure and
Applied Chemistry)
1.
Rantai tidak bercabang (lurus)
Jika rantai karbon terdiri dari 4 atom karbon atau lebih, maka nama
alkana diberi alawal n- (normal)
CH3 CH2 CH2 CH2 CH3 = n-pentana
2. Jika rantai karbon
bercabang, maka:
a. Tentukan rantai induk, yaitu rantai karbon terpanjang
dari ujung satu ke ujung yang lain. Rantai induk diberi nama alkana.
rantai induk terdiri dari
6 atom C, sehingga diberi nama heksana
b. atom C yang tidak terletak pada rantai induk/terpanjang sebagai nama gugus alkil
c. Penomoran. Berilan nomor pada
rantai induk dari ujung terdekat cabang. Sehingga atom C yang mengikat gugus
alkil mempunyai nomor terendah.
Jika nomor dari bawah, maka cabang ada di nomor 3. tetapi jika
dari kanan, maka cabang ada di nomor 4. Sehingga dipilih penomoran dari ujung
bawah. Urutan penulisan nama. Urutan penulisan nama untuk alkana bercabang:
Nomor cabang-nama cabang nama rantai induk:
Nama untuk struktur di
atas adalah: 3-metilheksana
d. jika terdapat lebih dari satu
alkil sejenis, maka tulis nonor-nonor cabang dari alkil sejenis dan beri awalan
alkil dengan di, tri, tetra, penta dan seterusnya sesuai dengan jumlah alkil
sejenis.
e. Jika terdapat dua atau lebih jenis alkil, maka nama-mana alkil
disusun menurut abjad.
f. Gugus alkil dengan jumlah atom C lebih banyak diberi nomor
yang lebih kecil.
Dari kiri, nomor 3 terdapat cabang etil
Dari kanan, nomor 3 terdapat cabang metil.
Sehingga yang dipilih adalah penomoran dari kiri: 3-etil-4metilpentana.
SOAL LATIHAN
F. ISOMERI ALKANA
Isomeri
alkana adalah di mana senyawa-senyawa karbon mempunyai rumus molekul sama,
tetapi strukturnya berbeda dan penamaannya juga berbeda. Senyawa yang
berisomeri disebut isomer.
Contoh : C4H10
G. SIFAT ALKANA
A. sifat alkana
sifat alkana di
bagi menjadi dua yaitu secara fisika dan kimia.
1. Fisika
a. Pada suhu
kamar C1 - C4 verwujud gas, C5 - C14 berwujud cair, Dan C15 dst
berwujud padat.
b. Makin besar
masa molekul relatif makin tinggi titik leleh, didih, dan masa jenis. Tetapi
makin banya cabang , makin rendah titik didih.
c. Sukar larut
dalam air, tetapi larut dalam pelarut nonpolar misal tetra kloro metanan ( CCL4
)
2. kimia
Dapat
mengalami reaksi subtitusi( reaksi penggantian atom atau gugus dengan atom
atau
gugus yang lain
Contoh :
bereaksi dengan gas klorin .
Alkana + gas halogen -> halo alkana
+ asam Halida
H. Sumber dan Kegunaan
1.
Bahan Bakar, misal elpiji, kerosin, bensin dan solar.
2.
Pelarut,
3.
Pelumas, alkana dengan suhu tinggi ( jumlah atom karbon banyak )
misal C18H38.
I. MINYAK BUMI
Minyak Bumi merupakan bahan bakar yang dihasilkan oleh alam dari
fosil-fosil yang terpendam berjuta-juta tahun. Fosil adalah sisa
tulang-belulang binatang atau sisa tumbuhan zaman purba yang telah membatu dan
tertanam di bawah lapisan tanah. Minyak mentah (petroleum) adalah campuran yang
kompleks, terutama terdiri dari hidrokarbon bersama-sama dengan sejumlah kecil
komponen yang mengandung sulfur, oksigen, dan nitrogen dan sangat sedikit
komponen yang mengandung logam.
5.
Struktur hidrokarbon yang ditemukan dalam minyak mentah adalah
alkana (parafin), sikloalkana (napten), dan aromatik. Proporsi dari ketiga tipe
hidrokarbon sangat tergantung pada sumber minyak bumi.Pada umumnya alkana merupakan hidrokarbon yang terbanyak tetapi
kadang-kadang mengandung sikloalkana sebagai komponen yang terbesar, sedangkan
aromatik selalu merupakan komponen yang paling sedikit. Untuk memisahkan
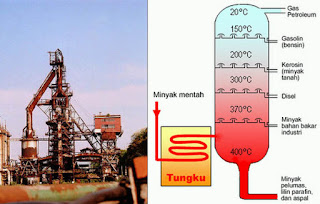
fraksi-fraksi dalam minyak bumi dapat dilakukan dengan cara distilasi
bertingkat. Setelah melalui distilasi bertingkat minyak bumi akan terpisah
menjadi gas, bensin, kerosin, solar dan lain-lain. Hasil distilasi tersebut
digunakan untuk menggerakan berbagai mesin, seperti: mobil, pesawat, mesin diesel
dan lain-lain, untuk keperluan industri, aspal dan sebagainya.
6.
PROSES PEMBENTUKAN MINYAK BUMI
7.
Minyak bumi dan gas alam berasal dari jasad renik lautan,
tumbuhan dan hewan yang mati sekitar 150 juta tahun yang silam .
Sisa-sisa organisme itu mengendap di dasar lautan, kemudian ditutupi oleh
lumpur. Lapisan lumpur tersebut lambat laun berubah menjadi batuan karena
pengaruh tekanan lapisan di atasnya. Sementara itu dengan meningkatnya tekanan
dan suhu, bakteri anerob menguraikan sisa-sisa jasad renik itu dan mengubahnya
menjadi minyak dan gas.
8.
proses pembentukan minyak bumi dan gas ini memakan waktu jutaan
tahun. Minyak dan gas yang terbentuk meresap dalam batuan yang berpori bagaikan
air dalam batu karang. Minyak dan gas dapat pula bermigrasi dari suatu daerah
ke daerah lain, kemudia terkonsentrasi jika terhalang oleh lapisan yang kedap.
Walaupun minyak bumi dan gas alam yang terbentuk di dasar lautan, banyak sumber
minyak dan gas yaang terdapat di daratan. hal ini terjadi karena pergerakan
kulit bumi, sehingga sebagian lautan menjadi daratan.
9.
1proses pembentukan minyak bumi
11. PENGOLAHAN MINYAK BUMI
a. Minyak bumi biasanya berada 3-4 KM dibawah permukaan. Minyak
bumi diperoleh dengan membuat sumur bor. suatu contoh anjungan pengeboran
minyak lepas pantai dapat dilihat pada gambar berikut :
1
1 b. Minyak mentah berbentuk cairan kental hitam dan berbau kurang
sedap. Minyak mentah belun dapat digunakan sebagai bahan bakar maupun untuk
keperluan lainnya, tetapi harus diolah terlebih dahulu. Minyak mentah
mengandung sekitar 500 jenis hidrokarbon dengan jumlah atom C-1 sampai 50.
1 c. pengolahan minyak bumi dilakukan melalui destilasi bertingkat, dimana
inyak mentah dipisahkan ke dalam kelompok-kelompok (fraksi) dengan titik didih
yang mirip. Pada suhu sekitar 400C kemudian dialirkan ke dalam menara
fraksionasi
1
12. pemisahan minyak bumi
1 komponen yang titik didihnya lebih tinggi akan tetap berupa
cairan dan turun ke bawah, sedangkan yang titik didihnya lebih rendah akan
menguap naik ke bagian atas melalui sungkup-sungkup yang disebut sungkup
gelembung. Makin ke atas suhu dalam menara fraksionasi semakin rendah. Sehingga
, setiap kali komponen dengan titik didih yang lebih tinggi akan mengembun dan
terpisah, sedangkan komponen yang titik didihnya lebih rendah naik ke bagian
yang yang lebih atas lagi. Demikian selanjutnya sehingga kom;ponen yang
mencapai puncak menara adalah komponen yang pada suhu kamar berupa gas.
1 Tabel fraksi Minyak Bumi
2
21. BENSIN
2 Salah satu bahan terpenting adalah bensin. Dipasaran bensin
tersedi dalam berbagai jenis yaitu premium, premix dan pertamax yang mempunyai
harga berbeda-beda sesuai dengan mutunya. Mutu bensin ditentukan oleh
efektifitas pembakarannya dalam mesin. Bahan bakar yang baik bila didalam mesin
tidak menimbulkan ketukan (knocking) atau mempunyai angka oktan/ angka efisien
yang tinggi.
Komposisi Bensin dan Bilangan Oktan Angka okatan atau bilangan oktan adalah bilangan yang menunjukkan perbandingan
komposisi antara rantai lururs (n-heptana) dan rantai bercabang (isooktana).
Karana komposisi bensin terdiri dari n-heptana dan isooktana, yang mempunyai
struktur sebagai berikut;
Bilangan oktan mempunyai nilai nol (untuk n-heptana) sampai seratus (untuk
isooktana). Bensin perdagangan diantaranya premium dengan angka oktan 82 yaitu
mengandung 82% iso oktana dan 18 % n-heptana.
Berdasarkan keterangan diatas,
a. Pertamax mempunyai nilai oktan 92, berarti terdiri dari ….% n-heptana dan
….% isooktana
b. Pertamax plus mempunyai bilangan oktan …. Yang terdiri dari 95 % isooktana
dan ….% n-heptana.
22. Zat Additif Bensin
Bensin yang merupakan hasil penyulingan minyak bumi mempunyai bilangan oktan
yang rendah(< 60), karena sebagian besar terdiri alkana rantai lurus.
Bilangan oktan yang rendah dapat ditingkatkan dengan menambahkan zat additive
anti ketukan yaitu yang memproses pengubahan alkana rantai lurus menjadi rantai
bercabang. Zat anti ketukan yang sudah digunakan diantaranya adalah :
a. Tetra Etil Lead (TEL)
Rumus molekul Pb(C2H5)4 . TEL dilarang penggunaannya karena saat penggunaannya
pada pembakaran bensin dapat menghasilkan oksida timah (PbO) yang menempel pada
komponen mesin. Agar (PbO) tidak menempel penggunaan TEL (65%) ditambahkan
dengan 1,2-dibromo etana dan 1,2-dikloro etana yang mengubah Pb menjadi PbBr2
(mudah menguap) yang keluar dari knalpot. Zat ini dapat mencemari udara dan
jika masuk ke dalam tubuh akan mengakibatkan anemia, sakit kepala dan bila
dalam kadar tinggi dapat menimbulkan kematian.
b. Ethyl Tertier Butil Ether (ETBE)
Rumus Molekul CH3O(C2H5)3
c. Tertier Amil Metil Eter (TAME)
Rumus molekul CH3 O (CH3) C2H5
d. Metil Tertier Butil Eter (MTBE)
Rumus Molekul CH3O(CH3)3
Additive yang paling banyak digunakan sampai saat ini. Namun penggunaannya juga
dibatasi karena beracun dan penyebab kanker. Bensin premix menggunakan campuran
MTBE dan TEL.
Gas buangan kendaraan yang mungkin menghasilkan CO, CO2, SO2 dan NOx. Gas
COsangat berbahaya kalau terhirup terlalu banyak dapat menyebabkan kematian,
sebab mengganggu proses pengikatan oksigen oleh hemoglobin.
2 DAMPAK PEMBAKARAN MINYAK BUMI
2 Pembakaran bahan bakar fosil (batubara, minyak bumi dan gas
alam) dapat menyebabkan masalah pencemaran lingkunagan, khususnya pencemaran
udara. Seperti yang terjadi di kota-kota besar dan padat penduduk. Agar lebih
memahami manfaat pemakaian bahan bakar fosil dan dampak yang mungkin terjadi,
akan dibahas berbagai pencemaran udara, efek rumah kaca dan hujan asam.;
1. Pencemaran Udara
Penggunaan bahan bakar fosil jika pembakarannya tidak sempurna dapat
menimbulkan pencemaran udara yang berupa partikulat atau gas dapat membahayakan
kesehatan manusia atau kestabilan bumi. Berikut beberapa pencemaran yang
mungkin terjadi :
a. Pengotor dalam bahan bakar
Batubara mengandung sedikit belerang dan saat dibakara akan menghasilkan SO2
dan meninggalkan abu yang mengandung oksida-oksida logam.
b. Bahan Additif
Untuk menaikkan bilangan oktan dalam bensin ditambahkan zat-zat additive yang
pembakarannya menghasilkan PbBr2 sebagai pencemar udara karena dapat merusak
ginjal, otak dan hati.
c. Karbon dioksida (CO2)
CO2 yang dihasilkan kendaraan bermotor sebenarnya tidak berbahaya bagi manusia,
namun peningkatan suhu permukaan bumi (efek rumah kaca) atau pemanasan global
yang berpengaruh pada iklim dan pencairan es di kutub
d. Karbon Monoksida (CO)
Pembakaran yang berlangsung tidak sempurna selain menghasilkan CO2 juga
menghasilkan CO dan Jelaga. CO beracun dan dapat menimbulkan rasa sakit pada
mata, saluran pernafasan dan paru-paru. Jika CO masuk dalam darah melalui
pernafasan dapat bereaksi dengan hemoglobin dalam darah membentuk karbosihemoglobin
sehingga menghalangi darah membawa oksigen ke seluruh tubuh sehingga tubuh
kekurangan oksigen yang dapat menimbulkan kematian yang diawali rasa lemas.
e. Oksida belerang (SO2 dan SO3)
Gas hasil pembakaran bahan bakar fosil khususnya batu bara adalah SO2 dan SO3.
Jika SO2 terhisap dalam pernafasan membentuk asam sulfit yang akan merusak
jaringan sehingga menimbulkan rasa sakit. Sedangkan jika yang terhisap SO3 akan
membentuk asam sulfat yang berbahaya. Jika oksida belerang larut dalam hujan
akan menyebabkan hujan asam.
f. Oksida Nitrogen (NO dan NO2)
Dalam silinder bunga api listrik menyebabkan sedikit nitrogen bereaksi dengan
oksigen membbentuk NO dan setelah keluar dari knalpot NO bereaksi dengan udara
(oksigen) membentuk NO2.
N2 + O2 2NO(g)
2NO(g) + O2(g) 2NO2(g)
Sebenarnya NO dan NO2 tidak beracun secara langsung tetapi NO bereaksi dengan
bahan pencemar lain menimbulkan asap kabut atau Smog yang dapat menimbulkan
iritasi pada mata dan saluran pernafasan. Smog juga mengurangi daya pandang dan
tanaman menjadi rumah kayu.
2. Efek Rumah Kaca (Greenhouse Effect)
a. Pengertian
Cahaya matahari dapat menembus atap kaca dan menghangatkan tanaman atau apa
saja yang terdapat dalam rumah kaca. Tanaman atau material apa saja yang
mengalami pemanasan tersebut akan memancarkan radiasi infra merah (gelombang
panas) yang akan diserap kaca dan meradiasikannya ke dalam rumah kaca dan
terjadi peningkatan suhu. Keadaan tersebut merupakan gambaran pengaruh sinar
matahari terhadap suhu permukaan bumi. Di atmosfer yang bertindak sebagai kaca
aC.°C dan jika tanpa GRK, suhu permukaan bumi diperkirakan mencapai
-25°dalah gas rumah kaca (GRK) yang meliputi karbondioksida (CO2),
uap air (CO), metana (CH4) dan senyawa golongan CFC. Jadi gas-gas tersebut
berfungsi sebagai selimut yang menjaga suhu permukaan bumi rata-rata sekitar 15
b. Gas-Gas Rumah Kaca (GRK)
1) Karbon dioksida (CO2)
CO2 merupakan gas rumah kaca paling penting karena kelimpahan diatmosfer paling
banyak. Akhir-akhir ini kelimpahan CO2 meningkat dengan adanya kemajuan
teknologi, pertambahan penduduk dan semakin banyaknya pabrik, kendaraan dan
pembakaran utan.
2) Uap air
Kelimpahan uap air di udara cukup besar, namun keberadaannya tidak terkait
langsung dengan aktivitas manusia, sehingga peningkatan atau berkurangnya tidak
mengkhawatirkan.
3) Metana
Kelimpahan metana jauh lebih sedikit dibandingkan CO2(g) dan H2O namun
mempunyai efek rumah kaca yang lebih kuat daripada CO2 per molekulnya.
Keberadaan CH4 merupakan hasil penguraian sisa-sisa tumbuhan.
4) Keluarga CFC
CFC merupakan gas rumah kaca namun keberadaannya dapat merusak lapisan ozon.
CFC dihasilkan dari penggunaan lemari es, berbagai alat semprot (deodorant,
minyak wangi, hairspray, berbagai pembersih dll)
3. Hujan Asam
Air hujan pada umumnya bersifat asam dengan pH (derajat keasaman) sekitar 5,7.
Jika air hujan mempunyai pH kurang dari 5,7 disebut hujan asam.
a. Penyebab hujan asam
Air hujan mencapai pH 5,7 (normal) dikarenakan melarutkan gas CO2 di udara
CO2(g) + H2O (l) H2CO3(aq)
Air hujan yang pH nya kurang dari 5,7 dikarenakan diudara banyak mengandung
pollutant : SO2, SO3 dan NO2 dengan reaksi sebagai berikut :
SO2(g) + H2O(l) H2SO3(aq) (asam sulfit)
SO3(g) + H2O(l) H2SO4(aq) (asam sulfat)
2NO2(g) + H2O(l) HNO2(aq) + HNO3(aq)
b. Dampak Hujan Asam
Hujan asam menimbulkan masalah lingkungan terutama tanaman, biota air dan
bangunan
1) Kerusakan hutan
Hujan asam dapat melarutkan unsure hara yang penting seperti kallsium dan
magnesium sehingga tanah bersifat asam yang tidak baik bagi tumbuhan. Selain
itu hujan asam membebaskan ion aluminium yang merupakan racun bagi tanaman dan
gas SO2 yang ada bersama hujan asam dapat mematikan daun tumbuhan.
2) Kematian Biota Air
Hujan asam mengakibatkan air sungai dan danau bersifat asam yang akan mematikan
ikan dan tumbuhan air.
3) Kerusakan bangunan
4) Hujan asam dapat merusak bangunan.
Bahan bangunan seperti batu kapur, marmer
dan beton sedikit banyak mengandung CaCO3 yang akan larut dalam asam
CaCO3(s) + 2HNO3(aq) Ca(NO3)2(aq) + H2O(l) + CO2(g)
c. Penanggulangan Hujan Asam
Terjadinya hujan asam dapat ditanggulangi dengan cara :
1) Menetralkan asamnya
Danau yang bersifat asam dapat dinetralkan dengan menambahkan CaCO3 yaitu basa
yang relative murah
2) Mengurangi emisi SO2 yang berasal dari pembangkit tenaga dengan batubara.
SO2 dapat dikurangi dengan menyerap SO2 sebelum memasuki cerobong asap. Zat
yang dapat menyerap SO2 adalah CaCO4 yang dapat digunakan untuk membuat plester
tembok/ plamir.
SO2 + CaCO3 CaSO3 + CO2
CaSO3 + ½ O2 CaSO4
3) Mengurangi emisi Oksida Nitrogen
Oksida nitrogen (NO) terutama berasal dari kendaraan bermotor. Hal tersebut
dapat dikurangi dengan jalan mengurangi laju kendaraan. Cara lain dilakukan
dengan mengubah katalitik pada knalpot kendaraan.