Tujuan
Pembelajaran Khusus
Melalui kegiatan mengamati, mempertanyakan,
mengeksplorasi, mengasosiasikan, dan mengomunikasikan diharapkan peserta didik
dapat:
1.
Menjelaskan
kesetimbangan dinamis.
2.
Menjelaskan
kesetimbangan homogen dan heterogen.
3.
Meramalkan arah pergeseran kesetimbangan kesetimbangan dengan asas Le Chatelier.
4.
Menjelaskan pengaruh perubahan suhu, konsentrasi, tekanan, dan volum pada pergeseran kesetimbangan
5.
Menjelaskan tetapan kesetimbangan..
6.
7. Menghitung harga Kc berdasarkan konsentrasi zat dalam kesetimbangan.
8.
9.
10.Menjelaskan kondisi optimum untuk memproduksi bahan-bahan kimia di industri yang didasarkan pada reaksi kesetimbangan.
Pendahuluan
Reaksi-reaksi kimia yang terjadi dapat berlansung dengan
sendirinya maupun yang sengaja dibuat oleh manusia.
Berdasarkan sifat berlangsungnya dapat dibedakan atas.
A. Reaksi
Searah / Reaksi Irreversibel ( à
)
Reaksi searah ialah reaksi yang berlangsung
dari kiri ke kanan atau disebut reaksi berkesudahan
Contoh : HCl
+ NaOH à NaCl + H2O
B. Reaksi
dapat balik / Reaksi reversibel (<===>
)
Reaksi searah ialah reaksi yang berlangsung
dari kiri ke kanan atau atau sebaliknya
N2 + 3H2 < == > 2NH3
Berdasarkan wujud zat dapat dibedakan
atas
1.
Kesetimbangan Homogen
adalah sistem kesetimbangan yang
komponennya mempunyai wujud yang sama.
2 SO2(g) + O2(g) ↔2 SO3(g)
2 SO2(g) + O2(g) ↔2 SO3(g)
2. Kesetimbangan Heterogen
adalah sistem kesetimbangan yang komponennya
terdiri atas zat-zat dengan wujud yang berbeda.
Reaksi: CO2(g) + H2O(l)↔ H2CO3(aq)
Ciri-ciri keadaan setimbang dinamis adalah sebagai berikut.
1. Reaksi berlangsung terus-menerus dengan arah yang berlawanan.
2. Terjadi pada ruangan tertutup, suhu, dan tekanan tetap.
3. Laju reaksi ke arah hasil reaksi dan ke arah pereaksi sama.
4. Tidak terjadi perubahan makroskopis, yaitu perubahan yang dapat diukur atau
dilihat, tetapi perubahan mikroskopis (perubahan tingkat partikel) tetap
berlangsung.
Hubungan konsentrasi pereaksi dan hasil Reaksi
1. [C] dan
[D] > [A] dan [B]
adalah sistem kesetimbangan yang komponennya
terdiri atas zat-zat dengan wujud yang berbeda.
Reaksi: CO2(g) + H2O(l)↔ H2CO3(aq)
Ciri-ciri keadaan setimbang dinamis adalah sebagai berikut.
1. Reaksi berlangsung terus-menerus dengan arah yang berlawanan.
2. Terjadi pada ruangan tertutup, suhu, dan tekanan tetap.
3. Laju reaksi ke arah hasil reaksi dan ke arah pereaksi sama.
4. Tidak terjadi perubahan makroskopis, yaitu perubahan yang dapat diukur atau
dilihat, tetapi perubahan mikroskopis (perubahan tingkat partikel) tetap
berlangsung.
Hubungan konsentrasi pereaksi dan hasil Reaksi
A + B < == > C + D
Ada 3 kemungkinan
2. [C] dan
[D] < [A] dan
[B]
3. [C] dan [D] = [A] dan [B]
B. FAKTOR – FAKTOR YANG MEMPENGARUHI
PERGESERAN KESETIMBANGAN
Jika
pada suatu system kesetimbangan dikenakan suatu aksi, maka system kesetimbangan
tersebut akan melakukan perubahan atau pergeseran kesetimbangan sebagai reaksi
untuk mengurangi pengaruh aksi tersebut pada system kesetimbangan (Azas Le-Chatelier)
Berikut
ini berbagai factor yang dapat mempengaruhi pergeseran kesetimbangan :
1. Perubahan konsentrasi
Perubahan
konsentrasi akan menggeser kesetimbangan ke arah yang jumlah zatnya lebih
sedikit. Jadi jika konsentrasi suatu zat diperbesar, maka kesetimbangan akan
bergeser ke arah yang berlawanan dengan penambahan zat tersebut, sebaliknya
jika konsentrasi suau zat diperkecil, maka kesetimbangan akan bergeser ke arah
pengurangan zat tersebut.
Contoh :
Pada
reaksi kesetimbangan A2(g) + B2(g) ↔2AB(g)
A2(g) + B2(g) : pereaksi/ sebelum reaksi
2AB(g) : Hasil pereaksi/ produk
· Jika konsentrasi A2 atau
B2 (pereaksi) diperbesar, maka kesetimbangan akan bergeser ke
kanan (ke arah produk)
· Jika konsentrasi A2 atau B2 (pereaksi) diperkecil, maka kesetimbangan akan bergeser ke
kiri (ke arah pereaksi)
· Jika konsentrasi AB (produk)
diperbesar, maka kesetimbangan akan bergeser ke kiri (kearah pereaksi)
· Jika konsentrasi AB (produk)
diperkecil, maka kesetimbangan akan bergeser ke kanan (kearah produk)
3. Perubahan tekanan
Jika tekanan diperbesar, kesetimbangan akan bergeser ke jumlah mol kecil (jumlah koefisien kecil).
Jika tekanan diperkecil, kesetimbangan akan bergeser ke jumlah mol besar (jumlah koefisien besar).
Jika jumlah mol/koefisien antara ruas kiri (pereaksi) dan ruas kanan (produk) sama, maka perubahan tekanan baik diperbesar maupun diperkecil tidak akan menggeser kesetimbangan.
Penting :
Yang diperhitungkan hanya zat yang fasenya gas (g) dan larutan (aq) saja, untuk fase yang lain padat (s) dan cair (l), diabaikan.
Contoh :
Pada reaksi kesetimbangan 2A(g) + B2(g) ↔2AB(g)
Jika tekanan diperbesar, maka kesetimbangan akan bergeser ke kanan (kearah produk) karena jumlah mol ruas kiri = 2 + 1 = 3 lebih besar daripada jumlah mol ruas kanan (produk) = 2
Jika tekanan diperkecil, maka kesetimbangan akan bergeser ke kiri (kearah pereaksi) yang memiliki jumlah mol lebih besar.
Pada reaksi kesetimbangan A2(g) + B2(g) ↔2AB(g)
Perubahan tekanan (diperbesar maupun diperkecil tidak akan menggeser kesetimbangan karena jumlah mol pereaksi (ruas kiri) = 1 + 1 = 2 sama dengan jumlah mol produk (ruas kanan) = 2
2. Perubahan volume
Jika
volume diperbesar, kesetimbangan akan bergeser ke jumlah mol besar (jumlah koefisien
besar).
Jika
volume diperkecil, kesetimbangan akan bergeser ke jumlah mol kecil (jumlah
koefisien kecil).
Jika
jumlah mol/koefisien antara ruas kiri (pereaksi) dan ruas kanan (produk) sama,
maka perubahan volume baik diperbesar maupun diperkecil tidak akan menggeser
kesetimbangan.
Penting
:
Yang diperhitungkan hanya zat yang fasenya gas (g) dan larutan (aq) saja,
untuk fase yang lain padat (s) dan cair (l), diabaikan.
Contoh :
Pada
reaksi kesetimbangan 2A(g) + B2(g) ↔2AB(g)
Jika
volume diperbesar, maka kesetimbangan akan bergeser ke kiri (kearah pereaksi)
karena jumlah mol ruas kiri = 2 + 1 = 3 lebih besar daripada jumlah mol ruas
kanan (produk) = 2
Jika
volume diperkecil, maka kesetimbangan akan bergeser ke kanan (kearah produk)
yang memiliki jumlah mol lebih kecil.
Pada
reaksi kesetimbangan A2(g) + B2(g) ↔2AB(g)
Perubahan
volume (diperbesar maupun diperkecil tidak akan menggeser kesetimbangan karena
jumlah mol pereaksi (ruas kiri) = 1 + 1 = 2 sama dengan jumlah mol produk (ruas
kanan) = 2
4. Perubahan suhu
Jika
suhu dinaikkan, maka kesetimbangan akan bergeser kearah endoterm (kearah ΔH =+).
Jika
suhu diturunkan, maka kesetimbangan akan bergeser kearah eksoterm (kearah ΔH= -)
Contoh :
Pada
reaksi kesetimbangan A2(g) + B2(g) ↔2AB(g) ΔH
= -25KJ
( reaksi tersebut reaksi eksoterm (ΔH bernilai = - )
Jika
suhu dinaikkan, kesetimbangan akan bergeser ke kiri (kearah pereaksi) karena
reaksi tersebut eksoterm (ΔH bernilai -) untuk produk, sehingga yg bernilai +
adalah pereaksi.
Jika
suhu diturunkan, kesetimbangan akan bergeser ke kanan (kearah produk) karena
reaksi tersebut ΔH produk bernilai –
Pada
reaksi kesetimbangan 2AB(g) ↔ A2(g) + B2(g) ΔH
= +25KJ
Jika
suhu dinaikkan, kesetimbangan akan bergeser ke kanan (kearah produk) karena
reaksi tersebut endoterm (ΔH bernilai +) untuk produk, sehingga yg bernilai +
adalah produk.
Jika
suhu diturunkan, kesetimbangan akan bergeser ke kiri (kearah pereaksi) karena
reaksi tersebut ΔH produk bernilai +, maka ΔH pereaksi bernilai –
Pengaruh
katalisator
Pada reaksi kesetimbangan, penambahan katalisator tidak akan mempengaruhi
pergeseran kesetimbangan, tetapi hanya akan mempercepat tercapainya keadaan
setimbang.
C. TETAPAN/HUKUM KESETIMBANGAN KIMIA
Dalam
kesetimbangan kimia terdapat hubungan antara kesetimbangan dengan persamaan
reaksi yang disebut hukum kesetimbangan.
1. Konstanta/hukum kesetimbangan konsentrasi (Kc) adalah perbandingan konsentrasi produk dan konsentrasi pereaksi
dipangkatkan dengan koefisien masing – masing pada suatu reaksi kesetimbangan.
Penting
: Pada reaksi kesetimbangan, perhitungan konstanta kesetimbangan
konsentrasi hanya melibatkan zat yang memiliki fase gas (g) dan larutan (aq)
saja. Sedangkan zat fase padat (s) dan cair (l) diabaikan dianggap = 1.
Pada
kesetimbangan :
m A(g) + n B(g) ↔ p C(g) + q D(g)
Secara
umum konstanta kesetimbangan dirumuskan dengan :
Kc =
konstanta kesetimbangan konsentrasi
A,B,C,D
= konsentrasi pereaksi dan produk (M) atau mol/Liter atau mmol/ml
m, n, p,
q = koefisien
Untuk Kesetimbangan Homogen ( fasa/wujud zat sama)
Contoh:
pada reaksi kesetimbangan 2H2(g) + O2(g) ↔ 2H2O(g)
rumus
Kc
= [H2O]2/[H2] 2.[O2]
Untuk Kesetimbangan Heterogen( fasa/wujud zat tidak sama)
Pada
reaksi : 2 AB(s) + C(aq) ↔ 3AD(s)
Kc = [AD]3/[AB]
2.[C]
Sedangkan zat fase padat (s) dan cair (l) diabaikan dianggap = 1.
Kc = 13/1 2.[C]
Kc = 1/[C]
Pada
reaksi kesetimbangan yang memiliki harga tertentu, dapat dibandingkan antara
satu dengan yang lainnya yaitu :
· Jika reaksi dibalik, maka harga Kc
menjadi 1/Kc
Contoh
perhitungan
tetapan kesetimbangan konsentrasi :
Suatu percobaan dalam ruang 2 liter terdapat 0,4 mol gas N2O4yang
terurai menjadi gas NO2. Setelah setimbang, ternyata terdapat 0,1 mol N2O4 .
tentukan Kc dan derajat disosiasi kesetimbangan tersebut!
Tetapan kesetimbangan berdasarkan tekanan gas
dinyatakan dengan notasi Kp, yaitu hasil kali tekanan parsial
gas-gas hasil reaksi dibagi dengan hasil kali tekanan parsial gas-gas pereaksi,
masing-masing tekanan parsial gas dipangkatkan koefisiennya menurut persamaan
reaksi.
3. Hubungan Kc dengan Kp
Apabila harga salah satu tetapan kesetimbangan sudah diketahui, maka untuk menghitung tetapan kesetimbangan yang lain dapat ditentukan dengan rumus :
Apabila harga salah satu tetapan kesetimbangan sudah diketahui, maka untuk menghitung tetapan kesetimbangan yang lain dapat ditentukan dengan rumus :
Kp = Kc.(RT)Δn atau
Kc = Kp.(RT) –Δn
R = tetapan gas umum = 0,082
T = suhu dalam Kelvin ( = t0C + 273)
Δn = jumlah koefisien kanan – jumlah koefisien kiri
4. Derajat disosiasi (
Derajat disosiasi adalah
perbandingan antara jumlah mol yang terurai dengan jumlah mol mula-mula.
Contoh:
2NH3(g) N2(g) + 3H2(g)
besarnya nilai derajat disosiasi (ᾳ):
ᾳ
|
=
|
mol zat yang terurai
|
mol zat mula-mula
|
Harga derajat disosiasi terletak antara 0 dan 1, jika:
a = 0 berarti tidak terjadi penguraian
a = 1 berarti terjadi penguraian sempurna
0 < ᾳ <1 o:p="">
a = 1 berarti terjadi penguraian sempurna
0 < ᾳ <1 o:p="">
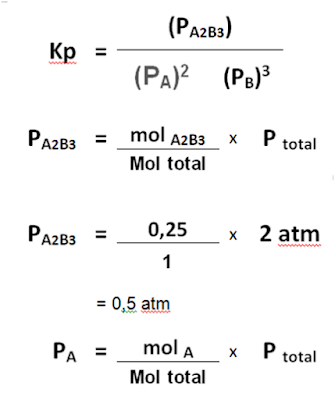
Ke dalam ruangan tertutup 5
liter dimasukkan 1 mol gas A dan 1 mol gas B. Kemudian gas-gas tersebut
bereaksi menurut persamaan reaksi berikut :
2A + 3B ⇌ A2B3
Jika saat kesetimbangan tercapai masih terdapat 0,25 mol gas B, tekanan ruang 2 atm , maka tentukanlah
2A + 3B ⇌ A2B3
Jika saat kesetimbangan tercapai masih terdapat 0,25 mol gas B, tekanan ruang 2 atm , maka tentukanlah
a. harga Kc dari reaksi tersebut !
b. harga Kc dari reaksi tersebut !
c. harga derajat disosiasinya zat A dan zat B
Diketahui
mol A= 1 ( mula-mula)
mol B= 1 ( mula-mula)
mol B= 0,25
( setimbang)
tekanan total= 2 atm
Reaksi : 2A +
3B ⇌ A2B3
Mula-mula : 1 1
-
Reaksi : 0,5 0,75 0,25
mol total = 0,5 + 0,25 + 0,25 = 1
[A] = mol/ liter = 0,5mol / 5 liter = 0,1 M
[B] = mol/ liter
=0,25 mol / 5 liter = 0,05 M
[A2B3] = mol/ liter =0,25 mol / 5 liter = 0,05 M
Jawab :
b. harga Kp